|
|
|
|
Тітова О.С, Столярова Н.В Як розв’язувати задачі з хімії?
| |
ЗМІСТ
1. Закони газового стану З
2. Хімічний еквівалент речовини 12
3. Термохімія 18
4. Швидкість хімічної реакції 29
5. Хімічна рівновага 39
6. Концентрація розчинів 48
7. Фізико-хімічні властивості розчинів 61
8. Електролітична дисоціація 71
9. Гідроліз солей 81
10. Електроліз 86
11. Відповіді 95
|
1. Закони газового стану
Для газів і речовин, що знаходяться у пароподібному стані, використовують наступні характеристики: М - молярна маса - це маса одного моля будь-якої речовини, яку у хімічній практиці найчастіше виражають у грамах на моль(г/моль). Na - число Авогадро - кількість атомів або молекул, що міститься в одному молі любого газу; дорівнює 6,022-10'23 моль'1.V - кількість молів речовини, яка визначається за формулами:
де т маса речовини; V- об'єм газу; молярний об'єм - об'єм, що займає один моль будьякого газу за нормальних умов (н.у.). Для всіх газів ця величина є сталою і дорівнює 22,4 л (22,4 дм3).
Тиск - 101,3 кПа, температура - 273 К, об'єм, який займає газ за цих умов, мають назву нормальні умови газового стану і позначаються ро. То, Vo відповідно.
Основним законом газового стану є закон Авогадро. у рівних об'ємах різних газів за однакових температури і тиску знаходиться однакове число молекул.
У хімічних дослідженнях часто користуються наслідками із закону Авогадро:
- один моль будь-якого газу за н.у. займає: об'єм 22,4 л;
- один моль любого газу за н.у. містить 6,022-10 молекул.
Визначення молярного об'єму газу за законом Авогадро
Для молярного об'єму газу справедливе співвідношення
де М - молярна маса газу; р - густина газу.
Величини М та р є сталими, тому молярний об'єм будь-якого газу за ну. також є сталою величиною і дорівнює 22,4 дм^/моль.
Якщо газ, взятий у кількості 1 моль, то V0 = VM. Із збільшенням кількості речовини газу його об'єм збільшується:
Отже маємо:
де v - кількість молів газу; Гм - молярний об'єм газу; - об'єм газу за н.у.; V- об'єм газу.
Задача 1. Який об’єм займає 0,5 моль кисню?
Задача 2. Металева посудина містить 213 кг рідкого хлору Сl2. Який об'єм займає хлор цієї маси за н. у.?
Задача 3. Визначити молярну масу газу, який при температурі °С і тиску 96 кПа займає об’єм 2 дм3 і мас масу 10,08 г.
Задача 4. Чому дорівнює відносна густина пропану CjHg за повітрям?
Задача 5. Відносна густина газу за повітрям дорівнює 0,138. Яка відносна густина цього газу за воднем?
Задача 6. Скільки атомів містять молекули ртуті в її парі, якщо густина пари ртуті за повітрям складає 6,92?
Задача 7. Визначити відносну густину газу за повітрям, якщо маса певного об'єму газу (н.у.) дорівнює 2.32 г, а маса такого самого об'єму повітря (н.у.) - 2,58 г.
Задача 8. Обчислити густину газу за воднем, якщо маса 800 мл цього газу при тиску 627 мм рт. ст. та температурі 39 °С дорівнює 0,873 г.
Задача 9. Обчислити густину за воднем газової суміші, яка за н.у. містить 14 л водню, 56 л аргону та 28 л азоту.
Задячі для самостійного розв'язання
1.1.Скільки атомів при деякій температурі містить молекула сірки, якщо густина її пари складає 2,21?
1.2.Яку формулу має сполука азоту з воднем, якщо густина її за повітрям становить 1,11, а при спалюванні 8 г цієї сполуки одержано 5,6 л азоту?
1.3.Чому дорівнює атмосферний тиск на вершині гори, якщо при 0°С маса 1 л повітря дорівнює 0,7 г?
1.4.Який об'єм водню при температурі 17 °С та тиску 102,4 кііа виділиться при розчиненні 1,5 кг цинку у соляній кислоті?
1.5.Чому дорівнює тиск кисню у колбі місткістю 750 мл і масою 82,1г, якщо маса цієї колби з киснем при 27 °С становить 83,3 г?
1.6.Чому дорівнює молярна маса газу, якщо густина його за повітрям становить 0,138?
1.7.Визначити дійсну формулу оксиду азоту, який містить 36,84 % азоту та 63,16 % кисню, а густина цієї сполуки за повітрям складає 38.
1.8.Чому дорівнює відносна молекулярна маса речовини, якщо 0.000856 г його пари при 42 °С та тиску 102925 Па займає об’єм 0,000344 м3?
1.9.Чому дорівнює тиск при температурі 273 К у посудині місткістю 0,0112 м3, яка містить 0,042 кг азоту та 0,008 кг метану?
1.10.Який об'єм займає суміш 8 кг кисню та 7 кг азоту за н. у.?
1.11.Чому дорівнює тиск у посудині місткістю 0,0112 м3 при 0 °С, яка містить 0,001 кг водню, 0,0085 кг аміаку та 0,028 кг азоту?
1.12.За якого тиску азот масою 0,5 кг займатиме об'єм 0,005 м3 при температурі 773 К?
1.13.Чому дорівнює відносна густина газової суміші за воднем, якщо на кожні два об'єми азоту у суміші припадає три об'єми кисню?
1.14.Чому дорівнює маса І м3 газу за н.у., якщо його відносна густина за воднем становить 8,5?
1.15.Як зміниться об'єм газової суміші, що містить 40 л водню і 56 л сірчистого ангідриду, якщо спалити її та привести до ну.?
1.16.Чому дорівнює тиск за н.у. у посудині місткістю 0.0056 м3, яка містить 0,0005 кг водню, 0,01825 кг хлороводню та 0,0355 кг хлору?
1.17.Скільки молів водню можна одержати з етану, який знаходиться у балоні місткістю 15 л при температурі 170 °С і тиску ЮкПа?
1.18.Чому дорівнює молярна маса та густина пари за воднем речовини, маса 160 см3 пари якої за н.у. становить 0,57 г?
1.19.Чому дорівнює молярна маса та маса однієї молекули речовини, густина нари якої за азотом дорівнює 6?
1.20.Який об'єм кисню необхідно витратити дія повного спалювання оксиду вуглецю (11) та метану, якщо об'ємна частка метану у ній дорівнює 20%?
1.21.Який об'єм за н у займатиме 0,016 кг кисню?
1.22.Який час потрібний для того, щоб з посудини місткістю один см3, заповненої киснем за н.у., випустити газ зі швидкістю 10 молекул за секунду?
1.23.Чому дорівнює тиск окснлу сірки (IV) масою 0,0245 г у посудині місткістю 0,0245 м3 при 298 К ?
1.24.Який об'єм займає 10 кг оксиду сірки (IV) при 323 К та тиску 405,300 кПа?
1.25.Чому дорівнює тиск кисню масою 3,2 кг у посудині місткістю 0,02 м3 при 293 К ?
1.26.Чому дорівнює молярів маса газу, якщо маса 600 мл його за н.у. дорівнює 1,711 г?
1.27.Скільки молекул азоту знаходиться за н.у. у 0,001 см3 суміші цього газу з оксидом вуглецю (11), об'ємна частка якого у суміші складає 10** % ?
1.28.Густина етилену за киснем дорівнює 0,875. Чому дорівнює молярів маса газу?
1.29.Який об'єм в літрах займає суміш, для приготування якоївикористали 10 моль кислю, 20 моль азоту та 0,224 м3 оксиду сірKM(1V)?
1.30.Густина суміші метану та кисню за н.у. становить 1,2 г/л. Чому дорівнює об'ємна частка метану у цієї суміші?
1.31.Чому дорівнює за н.у. маса 11,2 л газової суміші, яка містить гелій, аргон та неон, якщо на один атом іелію в суміші припадає два атоми неону та три атоми аргону?
1.32.Газова суміш містить водень та азот. Масові частки газів у цієї суміші становлять відповідно 70 % та 30 %. Чому дорівнюють об'ємні частки газів у суміші за ну.?
1.33.Яка кількість атомів кисню міститься за ну. у 200 см3 оксиду вуглецю (IV)? |
2. Хімічний еквівалент речовини
Хімічним еквівалентом речовини називають умовну частку цієї речовини, яка у хімічних реакціях сполучається з одним атомом чи іоном водню або замішує його у хімічній реакції. Хімічній еквівалент речовини скорочено називають еквівалентом речовини. Наприклад, у реакції
2НС1 + Ni (ОН)2 = NiCl2 + 2Н20
два атоми водню молекул соляної кислоти реагують з однією молекулою Ni (ОН)2. Отже, можна вважати, що з одним атомом водню реагує умовна частинка, яка дорівнює 1/2 молекули Ni(OH)2 Цю умовну частинку називають еквівалентом Ni (ОН)2. Число 1/2 називається фактором еквівалентності feкв і для даної реакції feкв (Ni (ОН)2 ) = 1/2.
Для кислоти фактор еквівалентності дорівнює величині, оберненій її основності: fекв (кислоти) = 1 / N(H*), де N(H*) - основність кислоти, яка визначається числом іонів водню у молекулі кислоти, які при перебігу певної реакції заміщуються на метал.
Наприклад:
H3PO4 + NaOH - NaH2PO4 + H2O; fекв (H3PO4) - 1;
H3PO4 + 2NaOH = Na2HTO4 + 2H20; fекв (Н3PO4) = 1/2
H3PO4 + 3Na0H = Na3PO4 + ЗН20; fекв(H3PO4) = 1/3.
Для основи фактор еквівалентності дорівнює величині, оберненій її кислотності: fекв (основи) =---------; де N - кислотність основи, яка визначається числом іонів OH’ у молекулі основи, які при перебігу певної реакції заміщуються на кислотні залишки.
Наприклад:
Al(OH)3 + 2НСІ = AlOHCl2 +2НСІ; /.„ (Al (OH)3) = 1A
Добуток фактора еквівалентності на молярну масу цієї речовини називається молярної масою еквівалентів речовини (або еквіваїентною масою) та позначається E(X):
E(X)=Jca- M(X).
Еквівалентна маса складної речовини дорівнює сумі еквівалентних мас елементів або функціональних груп, що входять до її складу. Наприклад
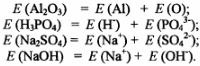
Еквівалентна маса складної речовини в окисно-відновних реакціях дорівнює відношенню молярної маси речовини до кількості електронів, які віддає або приймає молекула цієї речовини При розв'язуванні задач широко використовується закон еквівалентів: маси речовин, що реагують між собою, пропорційні молярним масам їхніх еквівалентів. Для рівняння реакції А + В ~ C + D можна записати:
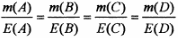
Якщо одна з реагуючих речовин с газом, тоді закон еквівалентів можна записати у такому вигляді:
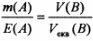
де V(B) - об’єм газу; Vm(B) - еквівалентний об'єм газу.
Якщо обидві з реагуючих речовин - гази, тоді закон еквівалентів можна записати у такому вигляді:
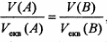
де И[А), ЦВ) -об'єми газів, VmJfi) еквівалентні об єми газів.
Еквівалентний об'єм газу - це об'єм, який займає молярна маса еквівалента газу.
Задача 1. При взаємодії 1,3 г гідроксиду невідомого металу із сірчаною кислотою утворилось 2,85 г соді. Визначити метал.
Задача 2. Колбу об'ємом 8 дм3 наповнили хлором (н.у.). Після окиснення в ній невідомого металу масою 12,8 г тиск у посудині зменшився на 56%. Визначити молярну масу еквівалента металу.
Задача 3. При взаємодії 3,6 г металу з розчином нітратної кислоти виділилось 693 см3 газу, виміряного при 27 0C та тиску 120 кПа Одержаний газ окиснюгться з утворенням бурого газу. Визначити метал і молярну масу еквівалента металу.
Задачі для самостійного розв'язання
2.1. Чому дорівнює молярна маса еквівалента оксиду металу, якщо на відновлення 0,00183 кг цього оксиду витрачено за н.у. 0,000833 м3 водню?
2.2. У розчин, що містив 2,24 г металу у вигляді сульфату, занурили цинкову пластину. Після повного виділення металу на пластині її маса збільшилась на 0,94 г. Чому дорівнює молярна маса еквівалента металу?
2.3. Чому дорівнює масова частка тривалентного металу в оксиді, якщо молярна маса еквівалента цього металу становить 15 г/моль?
2.4. Масові частки сірки і кисню в оксиді сірки становлять відповідно 40 і 60%. Чому дорівнює молярна маса еквівалента і валентність сірки у цьому оксиді?
2.5. Чому дорівнює масова частка металу в його оксиді, якщо молярна маса еквівалента металу дорівнює 31,8 г/моль?
2.6. Чому дорівнює молярна маса еквівалента металу і його оксиду, якщо 1,216 г металу за н.у. витісняє з кислоти 1,12 л водню?
2.7. Чому дорівнює молярна маса еквівалента металу, якщо його хлорид містить 65,57% хлору, а молярна маса еквівалента хлору становиїь 35,45 г/моль?
2.8. Який об'єм водню за н.у. виділиться під час його взаємодії і кислотою S г металу, молярна маса еквівалента якого складає 20 г/моль?
2.9. Який об’єм водню за н.у. буде витрачено на відновлення 112 г оксиду елементу, масова частка елементу в якому складає 71,43%, та чому дорівнює молярна маса еквівалента елементу?
2.10. Скільки алюмінію можна одержати з 2000 т бокситу, який містить 40% основної речовини А1203-2Н20:
2.11. Чому дорівнює еквівалентна маса галогену, якщо однакова маса металу реагує з 0,4 г кисню та 6,346 г галогену?
2.12. Чому дорівнює молярна маса еквівалента ортофосфорної кислоти, якщо при її взаємодії з лугом утворився гідрофосфат натрію
2.13. Чому дорівнює масова частка вуглецю у вугіллі, якщо при спалюванні 36 г вугілля утворилось 64 л діоксиду вуглецю?
2.14. Чому дорівнює еквівалентна маса двохосновної фосфорної кислоти, на нейтралізацію 4,1 г якої було втрачено деяку кількість розчину, що містив 4,0 г гідроксиду натрію?
2.15. Скільки оксиду кальцію можна одержати при термічному розкладі 20 г карбонату кальцію, що містить 20% домішок?
2.16. Чому дорівнює еквівалентна маса свинцю, якщо оксид свинцю містить 7,18% кисню?
2.17. Чому дорівнює молярна маса еквівалента цинку у реакції з хлороводнем, якщо при розчиненні 3,27 кг цинку ВИДІЛЯЄТЬСЯ 1,12 M3 водню за нормальних умов?
2.18. Визначити масу сірчаної кислоти, необхідну для розчинення 10 г цинку, валентність якого дорівнює двом:
2.19. Чому дорівнює молярна маса еквівалента металу, якщо на розчинення 0,01686 кг його витрачено 0,0147 кг сірчаної кислоти?
2.20. Скільки кисню необхідно для повного згорання 0,01 м3 сірководню?
2.21. Чому дорівнює молярна маса еквівалента фосфорної кислоти у реакції
H3PO4 + NaOH = NaH2PO4 + H2O? |
3. Термохімія
Перебіг багатьох хімічних реакцій супроводжується виділенням або поглинанням теплоти. У термохімії розрізняють два типи хімічних реакцій: екзотермічні, які супроводжуються виділенням теплоти, та ендотермічні, які супроводжуються поглинанням теплоти.
Сумарна величина енергетичних ефектів хімічної реакції називається тепловим ефектом хімічної реакції. Під час ізохорного процесу, коли система не виконує зовнішньої роботи, пов'язаної із зміною об'єму, вся теплота, що виділяється або поглинається , призводить до зміни внутрішньої енергії (U).
Q=U2- Ih=A U
де Q - теплота, що виділяється або поглинається; U2 та U внутрішня енергія кінцевого і початкового стану; AU - зміна внутрішньої енергії.
Для ізобарного процесу, при якому викону ється певна робота, пов'язана зі зміною об'єму: Q = AU+pAV, або Q = AH, де р - тиск; AV - зміна об' ему; AH - зміна ентальпії.
Додаткове значення AH відповідає поглинанню теплоти системою, від-ємне значення AH - виділенню теплоти.
Значення AH відноситься до того числа молів речовин, яке зазначено рівняітям реакції:
IH2 + O7 = 2Н: O + 483,6 кДж або 2Н: + Оз = 2Н: О; ЛЯ=- 483,6 кДж Ці рівняння показують, що при взаємодії' двох молів водню з одним молем кисню утворюються два молі води та виділяється 483,6 кДж теплоти
Основним законом термохімії є закон Гесса сумарний тепловий ефект ряду послідовних хімічних реакції не заіежіть від кількості стадій процесу, а залежіть тільки від початкового і кінцевого станів системи. Тобто, тепловий ефект хімічного процесу дорівнює сумі теплових ефектів окремих стадій
Утворення CO2 можна проілюструвати схемою:
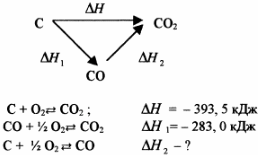
За законом Гесса:
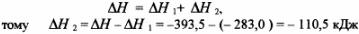
Теплота утворення та ентальія.
Тепловий ефект утворення одного моля будь-якої сполуки з простих речовин називають теплотою утворення. Теплоти утворення простих речовин вважають такими, що дорівнюють нулю, тому тепловий ефект реакції синтезу сполуки з простих речовин дорівнює теплоті утворення цієї сполуки. Якщо речовина існує у кількох алотропних видозмінах, то за нуль приймають теплотуутворення модифікації, яка є стійкою за стандартних умов. Для зіставлення різних реакції прийнято порівнювати всі термодинамічні величини віднесені до одного молю речовини та за стандартних умов. Стандартними умовами в термодинаміці вважають тиск 101,3 кПа та температуру 298 К. Термодинамічні величини та їх зміни, що характеризують речовину в її стандартному стані, називають стандартними та позначають за допомогою
Наприклад теплоти утворення сполук, виміряні за стандартних умов, позначаються AH .
Наслідок закону Гесса поз воля є розрахувати тепловий ефект хімічної реакції виходячи з теплот утворення речовин: тетовии ефект реакції (AH) дорівнює різниці сум теплоти утворення продуктів реакііії і вихідних речовин.
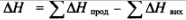
Самочинний перебіг будь-якого процесу — це перехід від упорядкованості до невпорядкованості Мірою невпорядкованості системи с ентропія (S). Зміна ентропії (AS) характеризуватиме можливість перебігу процесу Додатне значення AS вказує на самовільний перебіг процесу в системі, а від'ємне значення AS— на тс, що процес може відбуватися лише при затраті певної кількості енергії.
Енергія Пббса та напрячок перебігу хімічних процесів На перебіг хімічного процесу можуть впливати два фактори: ентальпійний та ентропійний Оскільки кожна система намагається перейти в стан з найменшим запасом енергії, самовільний перебіг будь-якого процесу має супроводжуватись зменшенням ентальпії системи. Однак кожна система намагається перейти з більш упорядкованого в менш упорядкований стан, що супроводжується збільшенням ентропії. Тобто, ентальпійний і ентропійний фактори протилежні за характером. Тому можливість перебігу хімічного процесу визначається енергією Гіббса (AG), яка враховує обидва фактори: ( AG = AH-TAS ).
Ентальпія або теплоємність системи при ізобарному процесі відповідає тепловому ефекту (A H) хімічної реакції.
Задача 1. Чому дорівнює зміна внутрішньої енергії AU при BHnapoeyrBaHHi 100 г води при / = 20 °С, якщо не враховувати зміну об'єму рідини та вважати, що водяна пара підпорядкована закону’ дія ідеальних газів? Питома теплота пароутворення води q= 2445 Дж/г
Задача 2. Визначить кількість тепла, яку можна отримати при горінні 1 кг метилового спирту, якщо реакція відбувається за рівнянням:
CH3OH + 1,5 O2 = CO2 + 2 H2O; ΔH = -722, 3 кДж
Задача 3. Обчисліть теплоту утворення діоксиду сірки, якщо при згоранні сірки утворюється 16 r SO2 та виділяється 73,48 кДж тепла.
Задача 4. Чому дорівнює тепловий ефект хімічної реакції
Задача 5. Чи можлива реакція горіння оксиду азоту ?
Задача б. Обчислити зміну ентропії реакції окислення аміаку
Задача 7. Чи можливо за нормальних умов встановлення заліза з його оксиду за допомогою водню , якщо Al! хімічної реакції дорівнює - 35,4 кДж/моль, а AS хімічної реакції дорівнює - 213,8 Дж/(К- моль)
Задача 8. Починаючи з якої температури можливе самочинне проходження процесу розкладення метану на прости речовини, якщо для хімічної реакцій CH4 = C + 2Нг:
Задача 9. Розрахувати енергію хімічного зв'язку' H- Cl, якщо відомо, що тепловий ефект утворення хлороводню дорівнює мінус 92 кДж. енергія дисоціації хлору дорівнює 243 кДж/моль, енергія дисоціації водню дорівнює 435 кДж/моль.
Задачн для самостійного розв'язання
3.1. Чому дорівнює тепловий ефект реакції
3.5. Чому дорівнює ентальпія реакції
3.6. При утворенні 1 моль газоподібного аміаку виділяється 46,2 кДж теплоти Чому' дорівнює зміна ентальпії у реакції взаємодії 22,4 л азоту з 3,36 л водню?
3.7. При утворенні 1 моль газоподібного AsH3 поглинається 184,8 кДж теплоти. Чому дорівнює зміна ентальпії у реакції взаємодії 22,4 л водню з 7,5 г арсену?
3.8. Чому дорівнює зміна ентропії реакції
3.11. Скільки теплоти поглинається при виділенні нормальних умов 6,72 л кисню за реакцією
3.12. При згорянні 28 г літію утворюється його оксид та виділяється 1189,6 кДж теплоти Чому дорівнює ентальпія утворення оксиду літію?
3.13. Яка маса гідроксиду кальцію розклалась, якщо зміна ентропії при цьому дорівнює 2,5 Дж моль 1IC1, а зміна ентропії у реакції
3.14. Скільки молів карбонату кадмію розклалась, якщо зміна стреаії при цьому дорівнює 1,73 Дж моль '-К а зміна ентропії у реакції CdCO3 -► CdO + CO2; AS0 = 173 Дж моль ‘ IC1 ?
3.15. Який об’єм водню за н. у. вступив у реакцію взаємодії з надлишком азоту, якщо при цьому виділилось 9,2 кДж теплоти, а тепловий ефект реакції
3.18. Чому дорівнює теплота утворення оксиду сірки (IV), якщо ідомо, що при спалюванні сірки виділилось 74,225 кДж теплоти, та утворилось 0,016 кг оксиду сірки (IV)?
3.22. Яка кількість теплоти виділяється при взаємодії за н.у. 5,6'10 ’ м3 кисню з оксидом сірки (IV), якщо AH02Ve цієї реакції дорівнює - 198,4 кДж?
3.25. Яка кількість теплоти виділиться при взаємодії алюмінію, масою 5,4 г з надлишком кисню, якщо теплота утворення його оксиду становить - 1650 кДж/моль?
3.26. Яка кількість теплоти поглинається при утворенні за н.у. 5,6-IOj M3 оксиду азоту (11), якщо термохімічне рівняння реакції окиси ення азоту
3.27.Чому дорівнює тепловий ефект реакції відновлення оксиду заліза (11) воднем, виходячи з наступних термохімічних рівнянь:
3.28. Який об'єм оксиду вуглецю (11) окислили, якщо зміна ентропії при цьому дорівнює AS0 = - 17 Дж/моль К, а зміна ентропії у реакції
3.29. Термохімічне рівняння відновлення оксиду заліза воднем перебігає згідно з рівнянням . При якій температурі починається процес відновлення оксида заліза, якщо зміна ентропії AS° = 0,1387кДж/моль К?
3.30. Яка кількість теплоти поглинається при утворенні 7,5 г оксиду азотуй 11). згідно з рівнянням Nw + Ow = 2NQ®, якщо відомі такі термохімічні рівняння реакцій:
3.31. Яка кількість теплоти виділиться при спалюванні 241,4 г суміші метанолу з етанолом, якщо кількості речовин компонентів CyfMimi відносяться як 3 : 1? Теплоти утворення метанолу, етанолу, оксиду вуглецю та води відповідно становлять: - 239,3 кДж/моль; - 277,0 кДж/моль; - 393,3 кДж/моль; - 286,2 кДж/моль; |
4. Швидкість хімічної реакції
Швидкість хімічної реакції визначається кількістю елементарних актів, що відбуваються за одиницю часу в одиниці об'єму (для гомогенної реакції) або на одиниці поверхні поділу фаз (для гетерогенної реакції):
де Vtom, Vrerep - швидкості гомогенної та гетерогенної реакцій; AC - зміна концентрації; At - проміжок часу; V- об'єм; S - поверхня поділу фаз. Для гомогенних процесів, що відбуваються без зміни об'єму, швидкість хімічної реакції визначають як зміну концентрацій реагуючих речовин (або продуктів реакції) за одиницю часу. Оскільки перебіг хімічної реакції характеризується безперервною зміною концентрації реагуючих речовин, можна говорити про швидкість хімічної реакції тільки у даний момент часу або про середню швидкість за певний час.
Зміни концентрацій реагуючих речовин знаходяться у стехіометричній залежності одна від одної, завдяки чому для визначення швидкості хімічної реакції можна скористуватися зміною концентрації однієї речовини. Швидкість реакції залежить від природи реагуючих речовин, їх концентрації, температури, а інколи й від наявності каталізатора.
Залежність швидкості реакції від концентрації реагуючих речовин описується законом діючих мас: швидкість хімічної реакції пропорційна добутку концентрацій реагуючих речовин у степенях, які дорівнюють стехіометричним коефіцієнтам, що стоять перед формулами речовин у відповідному рівнянні реакції: де V - швидкість хімічної реакції; [А] і [В] - концентрація реагуючих речовин; тіл- стехіометричні коефіцієнти; к - коефіцієнт пропорційності, який називається константою швидкості.
Наприклад, для реакції
У випадку гетерогенних реакцій у рівняння закону діючих мас входять концентрації лише тих речовин, які перебувають у газовій фазі або розчині. Наприклад, для реакції горіння вугілля:
С + 02 = С02
закон діючих мас запишеться так:
Збільшення або зменшення тиску газу у декілька разів відповідно збільшує або зменшує його концентрацію у таке само число разів. Зміна об'єму знаходиться в обернено пропорційній залежності із зміною концентрації газів: збільшення об'єму в деяке число разів відповідно зменшує концентрації газів у таке само число разів.
Яюцо перебіг хімічної реакції відбувається за рядом проміжних елементарних стадій, то швидкість цієї реакції визначається швидкістю найповільнішої з них. Залежність швидкості реакції від температури Експериментально встановлено, що залежність швидкості хімічної реакції від температури можна виразити у вигляді емпіричного провию Вант-Гоффа: підвищення температури на ожні 10 градусів збільшує швидкість реакції у 2-4 рази . де V2 - швидкість реакції при підвищеній температурі; V, - швидкість реакції при початковій температурі; Д/ - збільшення температури, у - температурний коефіцієнт (у = 2 ... 4 ). Температурний коефіцієнт швидкості реакції розраховується за рівнянням де V, і А, — швидкість і константа швидкості при температурі Г;
Vhio і А,*іо - швидкість і константа швидкості при температурі
Визначення концентрацій реагуючих речовин У хімічній кінетиці концентрація речовин вюначається кількістю молів у 1 дм3:
де: C - молярна концентрація; т - маса речовини; M - молярна маса речовини; V- об'єм речовини.
Задача 1 Як зміниться швидкість хімічної реакції NO + O2 *=* INO2 при збільшені концентрації NO у два рази, а концентрації O2 у три
Задача 2. Як зміниться швидкість реакції при збільшенні концеїгтрації NO у два рази, O2 — у три рази та одночасному збільшенні тиску у три рази?
Задача 3. Швидкість хімічної реакції при 0 °С становить 4 моль/дм3*с. Температурний коефіцієнт швидкості дорівнює 3. Обчислити швидкість реакції при ЗО °С.
Задача 4. При ЗО °С швидкість хімічної реакції дорівнює 0,15 моль/(дм3- хв), а при 50 °С — 2,4 моль/(дм3- хв). Чому дорівнює температурний коефіцієнт реакції?
Задача 5. Реакція перебігає за рівнянням Вихідні концентрації речовин становлять [NOJ - 0,4 моль/даг; - 0,6 моль/дм3. У скільки разів зміниться швидкість цієї реакції у той момент, коли прореагує 25% оксиду азоту (II)?
Задача 6. Реакція перебігає за рівнянням 2СО + O2 - 2С02. Вихідна концентрація оксиду CO дорівнює 0,4 моль/дм\ а O2 - 0,3 моль/дм3. У скільки разів швидкість цієї реакції буде відрізнятись від початкової у той час, коли концентрація CO дорівнює 0,2 моль/дм3? Позначимо початкову концентрацію речовини як (CO), а кінцеву як [CO].
Задача 7. Реакція при температурі 50°С відбувається за 2 хві 5с. За який час закінчиться ця реакція при температурі 70 °С, якщо у цьому температурному інтервалі температурний коефіцієнт швидкості реакції дорівнює 3 ?
Задачі для самостійного розв'язання
4.1. Як зміниться швидкість реакції при збільшенні концентрації NO у чотири рази, а концентрації кисню — у два рази?
4.2. Як зміниться концентрація реагуючих речовин, початкові концентрації яких однакові, якщо швидкість хімічної реакції
зменшити у IOO разів?
4.3. Як зміниться швидкість зворотної реакції при збільшенні концентрації кисню у 12 разів за умови постійного
тиску?
4.4. Як зміниться концентрація реагуючих речовин, початкові
концентрації яких однакові, якщо швидкість хімічної реакції
N2 + O2 = 2Ж)
збільшиться у 81 раз?
4.5. Чому дорівнює швидкість хімічної реакції
2802 + 02 = 280,,
якщо константа швидкості цієї реакції становить 3,5 с \ а концентра-
ції сірчистого ангідриду та кисню дорівнюють 2 моль/л?
4.6. Чому дорівнює швидкість хімічної реакції ЗН2 + N2 = 2 NHi, якщо константа швидкості цієї реакції становить 1,4 C11 а концентрації водню та азоту дорівнюють відповідно 1 моль/л та 3 моль/л?
4.7. Чому дорівнює швидкість хімічної реакції при температурі 80 °С, якщо при 50 0C швидкість її складає 2,13 моль/ (л-с), а температурний коефіцієнт цієї реакції дорівнює 2?
4.8. Чому дорівнює швидкість хімічної реакції при температурі 160 °С, якщо при 130 °С її швидкість складає 0,16 моль /(л*с), а температурний коефіцієнт цієї реакції дорівнює З?
4.9. Чому дорівнює швидкість хімічної реакції при температурі 110 °С, якщо при 70 °С її швидкість складає 1,3 моль/(лс), а температурний коефіцієнт цієї реакції дорівнює 2?
4.10. Як зміниться швидкість хімічної реакції 2СО+ O2 - 2СО2 при збільшенні концентрації CO у 5 разів, кисню у 7,5 разів, та одночасному збільшенню об’єму у 2,5 рази?
4.11. Як зміниться швидкість хімічної реакції 2СО+ O2 - 2С02 при збільшенні концентрації CO у 4 рази, кисню у 3 рази та одночасному збільшенню тиску у 1,5 рази?
4.12. Як зміниться швидкість реакції A2 + B2 —> 2 AB, яка перебігає у газовій фазі, якщо за умови збільшення тиску у 5 разів подвоїти концентрацію кожної з реагуючих речовин?
4.13. Як зміниться швидкість реакції PCl,+ Cl2 = PCl5 якщо концентрацію трихлориду фосфору збільшити у три рази, а концентрацію хлору — у два рази?
4.14. Як зміниться швидкість хімічної реакції 2СО+ O2 = 2СОз якщо концентрацію CO збільшити у три рази , а концентрацію кисню — у два рази?
4.15. Як зміниться швидкість хімічної реакції 2СО+ O2 = 2С02 якщо концентрацію CO збільшити у два рази, концентрацію кисню — у три рази, а тиск збільшити у 1,5 рази?
4.16. Як зміниться швидкість хімічної реакції 2СО+ O2 = 2СОз якщо концентрацію CO збільшити у три рази, концентрацію кисню
-у чотири рази, а тиск зменшити у шість разів?
4.17. Як зміниться швидкість хімічної реакції при збільшенні концентраіаї NO з 0,03 до 0,06 моль/л, а концентрат кисню з 0,05 до 0,1 моль/л?
4.18. Як зміняться концентрації реагуючих речовин (вихідні концеїттрації водню та йоду дорівнюють 3 моль/л) у той час, коли швидкість реакції зменшиться у 81 раз?
4.19. Як зміниться швидкість реакції якщо концентрацію кожної з реагуючих речовин збільшити у пять разів?
4.20. Чому дорівнює швидкість хімічної реакції при температурі 230 0C, якщо при температурі 150 °С вона дорівнює 0,35 моль/(лс), а температурний коефіцієнт становить 2?
4.21. До якої температури необхідно нагріти газову суміш, щоб швидкість реакції, яка при температурі 60 °С дорівнює 0,1 моль/(л с), збільшилась до 1,6 моль/(л-с), якщо температурний коефішєнт цієї реакції становить 2?
4.22. Як зміниться швидкість хімічної реакції при збільшенні концентрації фтору у два рази, водяних парів у 1,5 раза та одномасному зростанні тиску у два рази?
4.23. Як зміниться швидкість хімічної реакції при збільшенні концентрації фтору у два рази, зменшенні концентрації водяних парів у два рази, та одночасному зростанні тиску у три рази?
4.24. Як зміняться концентрації реагуючих речовин у той час, коли швидкість реакції зменшиться у 64 рази, якщо вихідні концентрації речовин А і В однакові?
4.25. Початкова концентрація речовини./! в реакції 2,4 моль/л, а швидкість реакції становить 0,02 моль/(л с). У скилькі разів зменшиться концентрація речовини А через 0.8 хвилини?
4.26. Швидкість хімічної реакції при температурі 10*С становить 2 моль/(лс). Температурний коефіцієнт реакції становить 3. Обчисліть швидкість реакції при температурі 40*С.
4.27. При нагріванні реакційної суміші з 40*С до 70*С швидкість хімічної реакції збільшилась у 27 разів. Чому дорівнює температурний коефіцієнт реакції?
4.28. Початкова концентрація хлору в реакції становить 1,6 моль/л. У скільки разів зменшиться концентрація цієї речовини через 10 хвилин, якщо середня швидкість реакції становить 0,1 моль/(лхв)?
4.29. При 404' тривалість реакції становить 4 хвилини. Температурний коефіцієнт становить 3. Чому дорівнює тривалість цієї реакції при температурі 10*С? |
|
|
|
|
